Скандий (Sc) является химическим элементом с порядковым номером 21 в таблице Mendeleev. Он был открыт в 1879 году ученым Ларсом Фредериком Нильсоном и вольфрамовым химиком Андерсом Готлибом Экессоном. Скандий получил свое название в честь Скандии - древнего названия Швеции, родины ученых.
Скандий - переходный металл, обладающий серебристо-белым цветом и ярким блеском. Он является относительно редким элементом в земной коре и встречается в виде минералов соединений скандия, таких как гадолинит и церит. Скандий имеет множество промышленных применений, включая использование в алюминиевых сплавах, ядерной энергетике и изготовлении специальных стекол.
Количество электронов на внешнем уровне скандия можно определить, исходя из его расположения в периодической таблице. Скандий находится в 4-м периоде и группе 3, что означает, что он имеет 2 электрона на внешнем уровне. Эти два электрона могут быть потеряны или приняты другими атомами, что позволяет скандию образовывать различные соединения и ионы.
Скандий: общие сведения о веществе

Скандий имеет серебристо-белый цвет и относительно мягкую текстуру. Он обладает высокой пластичностью и хорошо поддается обработке. Скандий является хорошим проводником электричества и тепла.
Элемент назван в честь скандинавской страны Швеция, где он впервые был обнаружен в 1879 году. Скандий обладает редкоземельными свойствами и находится в природе в виде минералов, таких как оксиды и силикаты.
Скандий играет важную роль в современных технологиях. Он используется, например, в производстве сплавов для создания легких и прочных материалов, а также в качестве катализатора в различных химических реакциях. Кроме того, скандий может использоваться в некоторых электронных устройствах и солнечных батареях.
Количество электронов на внешнем уровне

В атоме скандия на его внешнем электронном уровне находится 2 электрона. Это значит, что скандий имеет 2 валентных электрона и может образовывать соединения с другими элементами. Однако в скандии дополнительно на внешнем энергетическом уровне находятся 2 электрона, которые не являются валентными и заполняют d-орбиталь.
Такое расположение электронов на внешнем уровне делает скандий достаточно реакционноспособным химическим элементом, способным образовывать различные соединения и реагировать с другими элементами. Это позволяет скандию использоваться в различных отраслях промышленности и науки.
Скандий и его электронная конфигурация
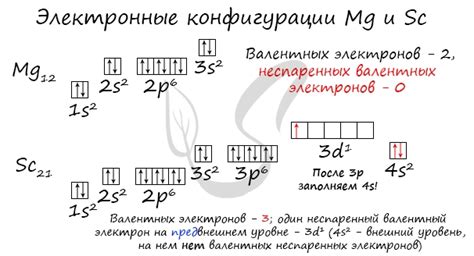
У скандия в его атоме имеется 21 электрон. Вот его электронная конфигурация:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
На внешнем энергетическом уровне скандия находится 1 электрон в подуровне d, что делает его металлическим элементом. Скандий является относительно редким элементом, который встречается в рудах минералов, таких как гадолинит и бастнесит.
Из-за своей высокой стойкости к коррозии, скандий находит широкое применение в различных областях, включая производство алюминиевых сплавов, электронику и ядерную энергетику.
Роль скандия в химических соединениях
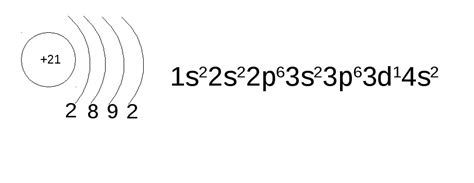
В химических соединениях скандий может находиться в различных окислительных состояниях, но наиболее распространенным является окисление +3. Благодаря этому свойству, скандий может образовывать соединения с другими элементами и играть важную роль в многих химических реакциях.
Одной из основных ролей скандия в химических соединениях является его способность увеличивать степень окисления других элементов. Например, скандий может быть использован как катализатор в различных органических реакциях, где он способен активировать молекулы и стимулировать химические превращения.
Скандий также широко применяется в производстве различных материалов, включая сплавы, керамику и стекло. Это объясняется его высокой прочностью, стойкостью к коррозии и способностью образовывать прочные связи с другими элементами.
Кроме того, скандий играет важную роль в электронике и оптике. Благодаря своей способности поглощать и испускать свет, материалы, содержащие скандий, используются в производстве светодиодов, лазеров и других устройств с оптическими свойствами.



