Азот - один из самых распространенных химических элементов, который встречается во множестве органических и неорганических соединений. Атом азота имеет на своем ядре 7 протонов и 7 нейтронов, что делает его атомным номером равным 7. Количество электронов в азоте тоже равно 7, так как количество протонов и электронов в атоме должно совпадать для обеспечения электрической нейтральности.
Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Они определяют химические свойства элемента и количество протонов в атоме является его атомным номером. В случае азота, 7 протонов конфигурируют его ядро.
Нейтроны - это частицы, не имеющие электрического заряда и находящиеся в ядре атома вместе с протонами. Они позволяют атому азота иметь стабильную структуру, так как отталкивание протонов компенсируется силой притяжения нейтронов. В случае азота, в ядре находятся 7 нейтронов.
Электроны - это отрицательно заряженные элементарные частицы, которые обращаются вокруг ядра атома в электронных оболочках. Они участвуют в химических реакциях и определяют свойства элемента. Количество электронов в азоте также равно 7, что обеспечивает его электрическую нейтральность.
Азот - элемент периодической таблицы
Азот относится к неметаллам и является главным составным элементом воздуха, составляя около 78% его объема. У азота есть 5 изомерных форм, из которых самой стабильной является молекула двухатомного газа, обозначаемая N2.
Структура атома азота:
- Протоны: 7
- Нейтроны: 7
- Электроны: 7
Азот имеет атомную массу приблизительно равную 14 г/моль. Он химически активен и образует многочисленные соединения с другими элементами. В биологии азот также играет важную роль, поскольку является составной частью белков, нуклеиновых кислот и других органических соединений.
Исторически первым удавшимся получить азот в чистом виде был шотландский химик Дэниел Резерфорд в 1772 году. Название "азот" происходит от греческого слова "azotos", что означает "безжизненный".
Строение атома азота

Атом азота состоит из 7 протонов, 7 нейтронов и 7 электронов. Протоны и нейтроны находятся в ядре атома, которое имеет положительный заряд, а электроны обращаются по орбитам вокруг ядра.
В таблице ниже приведена подробная информация о строении атома азота:
| Частица | Заряд | Масса |
|---|---|---|
| Протон | +1 | 1,673 x 10-27 кг |
| Нейтрон | 0 | 1,675 x 10-27 кг |
| Электрон | -1 | 9,109 x 10-31 кг |
Протоны и нейтроны, суммарно называемые нуклонами, составляют ядро атома, которое находится в центре. Масса нуклонов гораздо больше массы электронов, поэтому основная часть массы атома сосредоточена в ядре. Атом азота имеет атомный номер 7, что означает, что он содержит 7 протонов в ядре и 7 электронов на орбитах.
Число электронов в атоме азота

Атом азота (N) обладает атомным номером 7, что означает наличие семи электронов в его электронной оболочке. Электроны в азоте распределены следующим образом:
Первая электронная оболочка: 2 электрона (1s2)
Вторая электронная оболочка: 5 электронов (2s2 2p3)
Итого в атоме азота имеется 7 электронов.
Число протонов в атоме азота

Число нейтронов в атоме азота

Атом азота имеет атомный номер 7, что означает, что он имеет 7 протонов в своем ядре. В то же время, атом имеет среднюю атомную массу приблизительно 14.01 единицы, что указывает на наличие 7 нейтронов.
Число нейтронов в азоте может варьироваться. Наиболее распространенный изотоп - азот-14 - имеет 7 нейтронов. Однако также существуют другие изотопы азота, такие как азот-15, который имеет 8 нейтронов. Это объясняет, почему средняя атомная масса азота составляет 14.01 единицы.
Нейтроны являются частью ядра атома и не имеют электрического заряда. Они взаимодействуют с протонами, обеспечивая стабильность атома азота. Изменение числа нейтронов в азоте может привести к образованию различных изотопов с разной стабильностью и химическими свойствами.
Общая информация об азоте
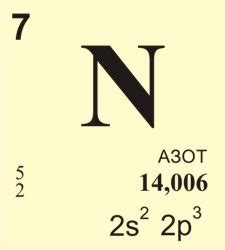
Азот является неметаллом и имеет символ N. Он относится к 14-й группе элементов и имеет 3 электрона во внешней оболочке.
Самым распространенным изотопом азота является азот-14, который состоит из 7 протонов и 7 нейтронов. Этот изотоп не обладает нуклеарной стабильностью и имеет полужизнь около 5730 лет. Азот-14 является вторым по распространенности изотопом в природе, после азота-15.
Азот широко используется в различных отраслях, включая сельское хозяйство, промышленность и научные исследования. В атмосфере азот составляет около 78% ее объема, что делает его одним из ключевых компонентов воздуха, необходимых для дыхания живых организмов.
Физические свойства азота

Азот имеет следующие физические свойства:
- Фаза при обычных условиях: газ;
- Цвет: безцветный;
- Запах: без запаха;
- Плотность: около 1.25 г/л;
- Температура плавления: -210.1 °C;
- Температура кипения: -195.79 °C;
- Теплота плавления: 0.72 кДж/моль;
- Теплота испарения: 5.56 кДж/моль;
- Теплоемкость: 29.1 Дж/(моль·К);
- Теплопроводность: 0.02591 Вт/(м·К);
- Электропроводность: 10^(-30) См;
- Вязкость: 17.81 мкПа·с;
Азот является неподвижным газом, не имеющим цвета и запаха. Он широко используется в различных отраслях, таких как сельское хозяйство, промышленность и медицина.
Химические свойства азота

| Свойство | Описание |
|---|---|
| Окислительность | Азот может выступать как окислителем, при этом образуя вещества с более низкой степенью окисления. Однако азот сам является слабым окислителем в сравнении с другими элементами. |
| Реактивность | Азот не реактивен при обычных условиях, однако при высоких температурах и давлениях может образовывать разнообразные соединения. |
| Образование соединений | Азот образует широкий спектр соединений, включая азотные кислоты, аммиак и нитраты. Эти соединения играют важную роль в биологических и промышленных процессах. |
| Кислотность | Азотные кислоты, такие как азотная и нитратная кислоты, обладают высокой кислотностью и могут проводить различные химические реакции. |
Эти химические свойства азота делают его важным элементом для жизни на Земле. Азот играет важную роль в составе аминокислот, нуклеиновых кислот и других органических соединений. Он также используется в промышленности для производства удобрений, взрывчатых веществ и других химических соединений.
Использование азота в промышленности

Одно из главных применений азота в промышленности - в качестве инертного газа. Благодаря своей неподвижности и отсутствию химической активности, азот широко используется в процессах, где необходимо предотвратить окисление, горение или взрыв. Например, азот используется в пищевой промышленности для упаковки пищевых продуктов, чтобы предотвратить их порчу и сохранить свежесть.
Азот также используется в процессе азотной хламидации, который является одним из способов укрепления поверхности металла. Этот процесс повышает твердость и износостойкость металлических изделий, что делает их более прочными и долговечными.
Другое важное применение азота - в производстве жидкого азота. Жидкий азот имеет экстремально низкую температуру и используется в различных отраслях промышленности, таких как электроника, медицина и производство пищевых продуктов. Например, в электронике жидкий азот используется для охлаждения электронных компонентов, чтобы предотвратить их перегрев. В медицине жидкий азот используется для криотерапии - лечения различных заболеваний путем охлаждения тканей.
Кроме того, азот используется в процессах синтеза аммиака и нитратов, которые широко используются в производстве удобрений. Аммиак и нитраты являются важными компонентами для повышения плодородности почвы и улучшения урожайности.
| Применение азота в промышленности: |
|---|
| - Инертный газ для предотвращения окисления и порчи продуктов питания. |
| - Азотная хламидация для повышения твердости и износостойкости металлических изделий. |
| - Производство жидкого азота для использования в электронике, медицине и производстве пищевых продуктов. |
| - Синтез аммиака и нитратов для производства удобрений и повышения урожайности. |
Как получают азот

Разделение воздуха является самым популярным способом получения азота. В этом методе сырой азот выделяется из воздуха, который состоит преимущественно из азота (около 78%) и кислорода (около 21%). Процесс разделения воздуха основан на различии в кипящих точках различных компонентов воздуха. Обычно используется метод ленточной дистилляции, при котором воздух охлаждается до низких температур и затем разделяется на различные компоненты. Азот собирается в жидком состоянии и затем снова преобразуется в газообразное состояние.
Аммиачный метод получения азота основан на реакции между азотом и водородом, при которой образуется аммиак. Аммиак затем окисляется для получения азота. Этот метод широко используется в промышленности для производства азотных удобрений.
Оба этих метода являются эффективными и широко применяемыми при получении азота в промышленных масштабах.



